濃酸對金屬腐蝕鈍化現象
2019-4-13 11:54:23 點擊:
某些活潑金屬或其合金表面在某些介質環境下會發生一種陽極反應受阻的現象,其電化學性能接近于貴金屬。金屬的這種失去了原來的化學活性的現象被稱為鈍化,金屬鈍化后所獲得的耐蝕性質稱為鈍性。鈍化大大降低了金屬的腐蝕速度,增加了金屬的耐蝕性。
金屬的鈍化現象早在20世紀初就被人們發現。例如,鐵在稀硝酸中腐蝕很快,而在濃硝酸中則腐蝕很慢。1836年,斯柯比稱金屬在濃硝酸中獲得的耐蝕狀態為鈍態。到目前為止人們對金屬的鈍化已進行了廣泛的研究,并在控制金屬腐蝕和提高金屬材料的耐蝕性方面發揮了十分重要的作用。
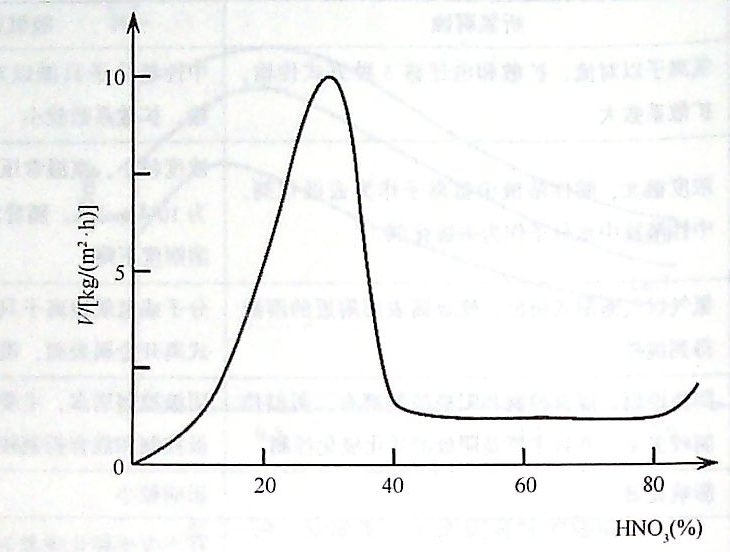
圖(1)鐵在硝酸中的溶解速率與硝酸的濃度關系
1)化學鈍化
將鐵片放人硝酸中,觀察鐵片溶解速率(腐蝕速度)與硝酸濃度的關系,得到如圖2-21所示的變化曲線。從圖中可以看出,當硝酸濃度較低時,鐵的溶解速率隨著硝酸的濃度增加而迅速增大。當硝酸濃度增加到為30%—40%時,鐵的腐蝕速度達到最大值。硝酸濃度超過40a/o時,鐵的溶解速率迅速降低,直到反應接近停止,這一異常現象即為鈍化。如果繼續增加硝酸濃度,使質量分數超過90qo時,腐蝕速度又有較快的上升,這一現象稱為過鈍化。經過濃硝酸處理的鐵再放人稀硝酸或硫酸中也能保持一定的時間不會受到腐蝕,其原因是金屬表面已經發生了鈍化。
除鐵之外,其他金屬如鉻、鎳、鉆、銅、鉭、鈮、鎢、鈦等,在適當條件下也會產生鈍化。能使金屬鈍化的物質統稱為鈍化劑,如濃硝酸、K,Cri0,、KMn0。、KC10。等強氧化劑以及溶液中或大氣中的氧。某些非氧化性試劑也能使某些金屬鈍化,例如鎂可在氫氟酸中鈍化,鉬和鈮可在鹽酸中鈍化,汞和銀在CI-的作用下電能發生鈍化。

圖(2)硫酸罐采用碳鋼材質制作主要因為鈍化現象
值得注意的是,鈍化的發生并不簡單地取決于鈍化劑氧化能力的強弱。例如,H:0:和KMn0。溶液的氧化還原電位比K,Cr.0,溶液高,是更強的氧化劑,但實際上它們對鐵的鈍化作用卻比后者更弱;Na:S:0。氧化還原電位更高,可是它反而不能使鐵鈍化。顯然,這與陰離子的特性及電位對鈍化過程的影n向有關。
綜上所述,金屬與鈍化劑的化學作用而產生的鈍化現象稱為化學鈍化或自鈍化。例如,鉻、鋁、鈦等金屬在空氣中和很多種含氧的溶液中都易被氧鈍化,故稱為自鈍化金屬。
金屬變為鈍態時,其電極電位一般朝正的方向移動。例如,Fe的電位為-0.2-0.2V.鈍化后升高到0.5—1.ov;Cr的電位為-0.6~0.4 V,鈍化后為0.8~l-0 V。由于電位升高,鈍化后的金屬失去原有的某些特性,例如鈍化后的鐵在銅鹽中不能將銅置換出來。
- 上一篇:壓力20MPa溫度160℃濃度20%HCl鹽酸浸泡4h試驗結 2019/4/22
- 下一篇:氫氟酸防腐蝕用KN17防腐耐磨涂料效果顯著 2016/9/5
